2023年FDA获批新药数量远超往年均值
 4062
2024-02-28
4062
2024-02-28
美国生物医药的受理和审评主要由美国食品药品监督管理局(FDA)的药物评价和研究中心(CDER)以及生物制品评价与研究中心(CBER)负责。CDER 的职责主要是审查并确保新药、仿制药和非处方药上市安全,其中包括对一些生物制品 的监管。CBER 则负责对生物和相关产品(包括血液、疫苗、过敏原、组织以及 细胞和基因疗法)进行审查和监管。
2023年,FDA 共批准了69款新药,这一数字创下了过去五年的新高。
CDER:新药数量接近历史纪录,创新机制成为主流
药物评估和研究中心(CDER)批准了55款创新药,获批总数为近 30 年第二高,具有创新机制(first-in-class)的疗法占比超过六成。在这些创新疗法中,小分子药物占比接近三分之二,彰显了此类药物的巨大潜力。其中包括17款生物制剂,9款获得孤儿药认定(orphan drug designation);另有38款新分子实体,20款获得优先审评(priority review),16款获得孤儿药指定(ODD)。
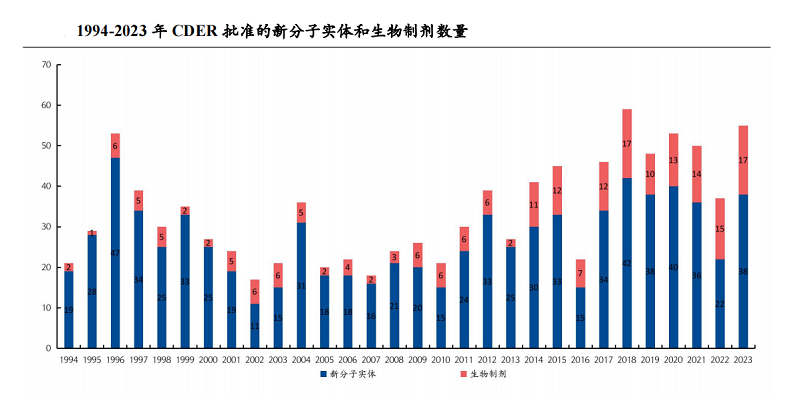
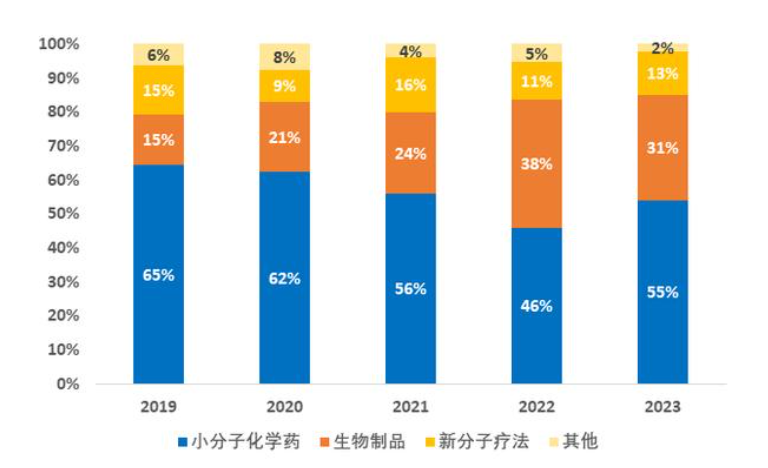
按药物类型划分,2023 年小分子仍然占据 CDER批准新药的主导地位,达到 30 款,占比为 55%(30/55)。以多肽类和核酸类药物为代表的新分子疗法(包括寡核苷酸疗法,多肽类疗法,以及抗体偶联药物)在过去5年中,其占比稳定在12%左右,表明它们已成为重要的新药来源。生物制品中,71%为抗体类(8款单抗、4款双抗),其余为酶替代疗法。
按疾病领域划分,2023年新药多集中在肿瘤和罕见病领域,其次为免疫炎症、感染、神经系统、心血管及代谢类疾病。
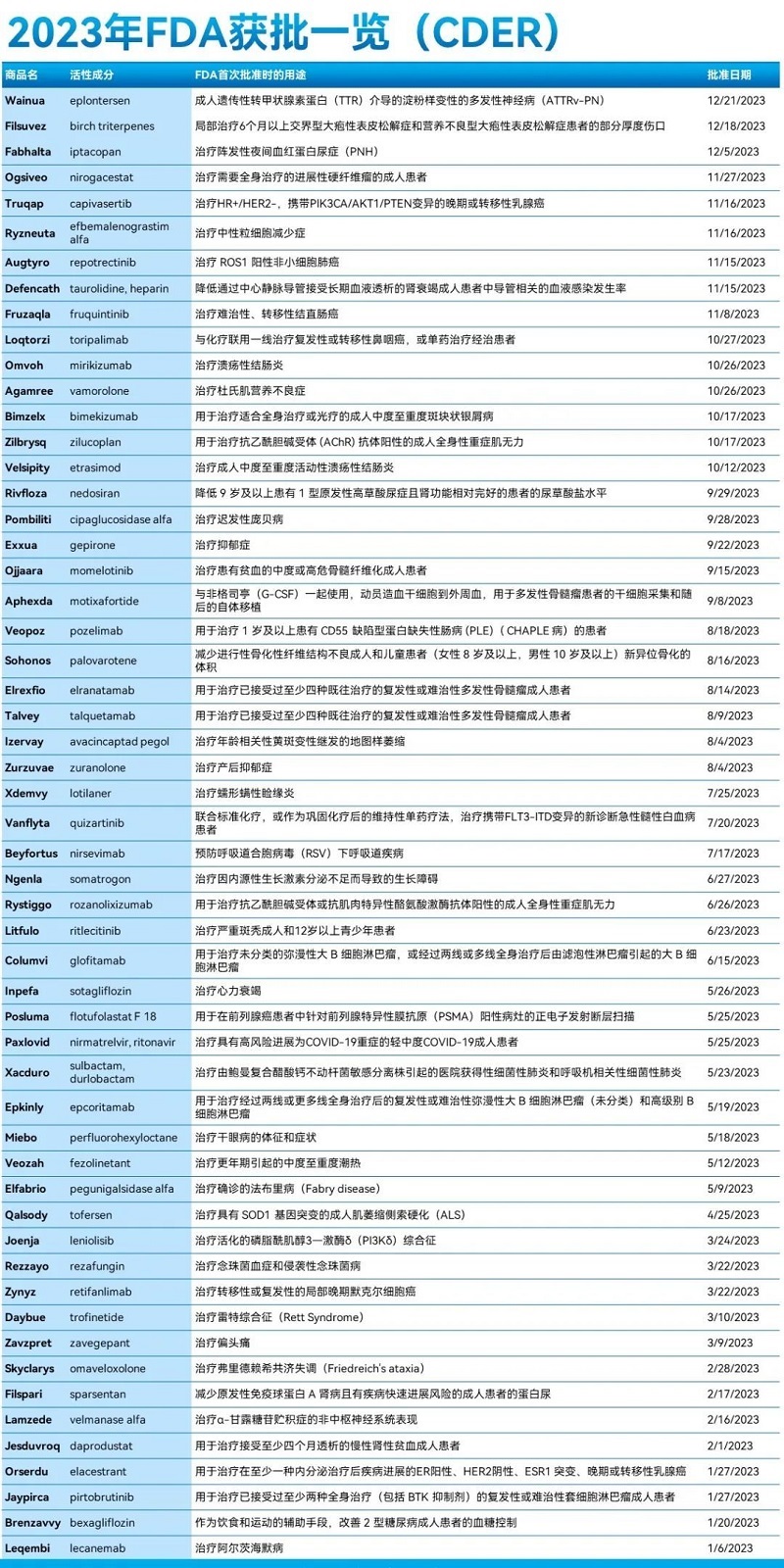
前衍可提供的供实验用原料药一览:
| 名字(活性成分) | CAS号 | 名字(活性成分) | CAS号 |
| Iptacopan | 1644670-37-0 | Nirogacestat | 1290543-63-3 |
| Capivasertib | 1143532-39-1 | Repotrectinib | 1802220-02-5 |
| Taurolidine | 19388-87-5 | Fruquintinib | 1194506-26-7 |
| Vamorolone | 13209-41-1 | Bimekizumab | 1418205-77-2 |
| Zilucoplan | 1841136-73-9 | Etrasimod | 1206123-37-6 |
| Gepirone | 83928-76-1 | Momelotinib | 1056634-68-4 |
| Motixafortide | 664334-36-5 | Palovarotene | 410528-02-8 |
| Zuranolone | 1632051-40-1 | Lotilaner | 1369852-71-0 |
| Quizartinib | 950769-58-1 | Nirsevimab | 1989556-22-0 |
| Rozanolixizumab | 1584645-37-3 | Ritlecitinib | 1792180-81-4 |
| Glofitamab | 2229047-91-8 | Sotagliflozin | 1018899-04-1 |
| Nirmatrelvir | 2628280-40-8 | Ritonavir | 155213-67-5 |
| Sulbactam | 68373-14-8 | Durlobactam | 1467829-71-5 |
| Fezolinetant | 1629229-37-3 | Tofersen | 2088232-70-4 |
| Leniolisib | 1354690-24-6 | Rezafungin | 1396640-59-7 |
| Trofinetide | 853400-76-7 | Zavegepant | 1337918-83-8 |
| Omaveloxolone | 1474034-05-3 | Sparsentan | 254740-64-2 |
| Daprodustat | 960539-70-2 | Elacestrant | 722533-56-4 |
| Pirtobrutinib | 2101700-15-4 | Bexagliflozin | 1118567-05-7 |
| Lecanemab | 1260393-98-3 |
CBER:基因疗法蓬勃发展,创新源源不断
生物制品评估和研究中心(CBER)批准了14款生物制品(不含血浆和免疫球蛋白),其中包括5款疫苗、5款基因治疗产品(涵盖全球首个获批的CRISPR基因编辑疗法Casgevy,近2年已批准近10款基因疗法)、2款细胞治疗产品,以及首款口服粪便微生物群产品Vowst。
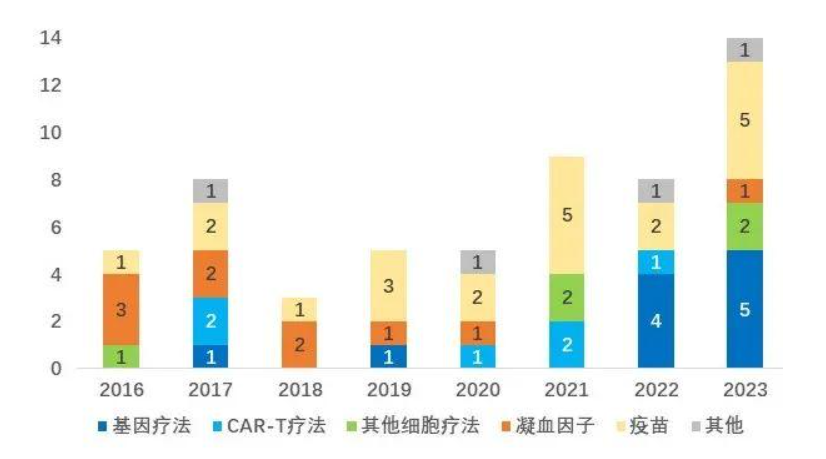

*仅统计细胞疗法、基因疗法、重组凝血因子、以及疫苗类药物。CBER的批准中还包括血浆、免疫球蛋白等其他产品。
