终结艾滋病?一年二针,100%有效预防
 5701
2024-07-17
5701
2024-07-17
2024年6月20日,吉利德公司在其官方网站上宣布,在一项关键的3期PURPOSE 1临床试验中,每年仅需两次注射的长效药物lenacapavir在预防女性HIV感染上显示出100%的有效性。

作为首创的长效HIV衣壳抑制剂,Lenacapavir通过阻断病毒生命周期的关键环节来有效控制HIV-1的增殖。该药物在2022年8月首次在欧洲获得市场准入,并于同年12月获得美国FDA的批准,成为全球首个也是唯一一个每年仅需两次注射的HIV治疗药物。
吉利德所公布的数据来自其全面和多样化的PURPOSE临床项目,该项目共包括全球5项HIV预防试验,此次是PURPOSE项目产生的首批数据-PURPOSE 1。这是一项双盲、随机3期研究,目的是比较lenacapavir与Truvada和Descovy在16至25岁女性群体中作为PrEP(Pre-exposure Prophylaxis,暴露前预防)的安全性和效果。。
参与PURPOSE 1试验的受试者,包括来自南非25个地区和乌干达3个地区的5300余名16至25岁的年轻女性及青春期少女。参与者被随机分为三组,比例为2:2:1,分别接受了每年两次的Lenacapavir皮下注射,每日一次的Descovy口服治疗(恩曲他滨200mg/丙酚替诺福韦25mg),以及每日一次的Truvada口服治疗(恩曲他滨200mg/富马酸替诺福韦二吡呋酯300mg)。
临床试验结果显示,Lenacapavir组的2134名女性未发现HIV感染案例;相比之下,Truvada组的1068名女性中有16起感染事件(发病率为1.69每100人年),Descovy组的2136名女性中有39起感染事件(发病率为2.02每100人年)。Lenacapavir不仅优于主要比较对象HIV基准感染率bHIV(发病率为2.41每100人年)和Truvada(次要对照组),不仅成功实现了研究的主要和次要目标,还显示出优异的整体耐受性,并没有发现任何重大或新的安全问题。
当前,吉利德正在进行其他旨在评估lenacapavir作为PrEP用途的PURPOSE临床试验。公司计划在2024年年末或2025年年初发布另一项关键试验PURPOSE2的结果,该试验旨在评估半年一次的lenacapavir注射在预防HIV感染方面对不同性别取向的男女个体的有效性。若PURPOSE1和PURPOSE2的试验结果均呈正面,吉利德将把这两项试验的数据纳入lenacapavir作为HIV PrEP疗法的监管申请中,以确保该药物能获得批准,服务于那些迫切需要更多HIV预防选项的多样化群体。
虽然Lenacapavir本质上是一种长效药物,但其注射频率与某些疫苗相似,并且其100%的有效率远远超过了任何HIV试验性疫苗,因此市场上将其视为一种“疫苗”也就不足为奇了。
当然,将Lenacapavir称为“疫苗”只是一种比喻。然而,这种比喻背后所隐含的深层意义,实际上预示着HIV防治领域的一次重大转变。
毕竟,这是人类抗击艾滋病历史上首次公布的零感染率的HIV预防三期临床试验,Lenacapavir每年仅需两次注射,具有显著的依从性优势,标志着一项具有里程碑意义的新突破,有望成为一款颠覆性新药。
前衍可提供产品
 |
 |
 |
|
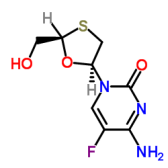
2189684-44-2 HIV-1衣壳抑制剂Lenacapavir |
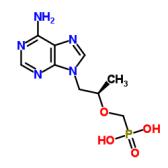
143491-57-0 恩曲他滨 |
147127-20-6 替诺福韦 |
