借助流动化学,制备三氟甲基杂原子阴离子
 2631
2024-10-25
2631
2024-10-25
在药物化学、农用化学品和功能材料等领域,含有三氟甲基(CF(3))的化合物扮演着关键角色。例如,美国食品和药物管理局(FDA)批准的药物中,大约5%含有这种结构。氟原子的吸电子特性能够引起周围基团的显著极化,从而增强局部的疏水性,同时,氟化官能团还能增强化合物的代谢稳定性,提升其生物活性。数十年来,化学家们一直在探索将三氟甲基引入有机分子的有效方法,并已开发出多种构建C-CF(3)键的策略。近期,科学家们对与杂原子结合的三氟甲基(例如三氟甲氧基(OCF(3))、三氟甲硫基(SCF(3))和N-三氟甲基(NCF(3)))表现出了浓厚的兴趣(见图1A),因为这些结构能够进一步调整分子的亲脂性、抗氧化性和酸碱性。尽管如此,这些基团在活性药物成分(APIs)中的比例非常低,不到含CF(3)药物的10%,这主要是因为合成这些基团的方法非常有限,并且通常依赖于成本高昂、对湿度敏感且原子效率不高的试剂(见图1B)。此外,这些试剂的合成过程复杂,且会产生大量的氟化废物。
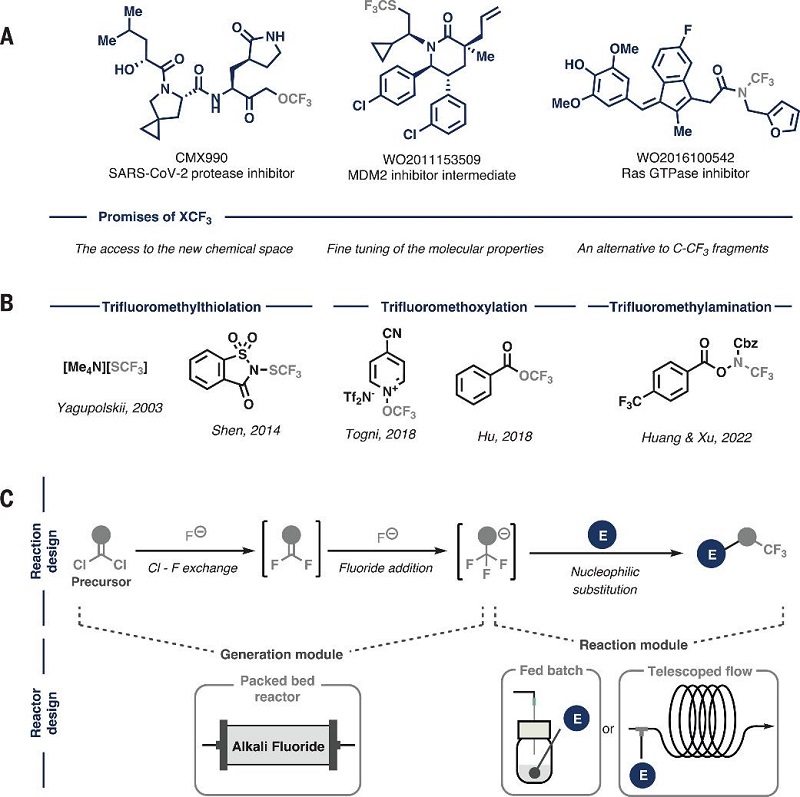
图1. 研究概述。图片来源:Science
最近,荷兰阿姆斯特丹大学的Timothy Noël教授领导的研究团队采用了流动化学技术,使用氟化铯作为氟源,成功将市售或易于合成的稳定有机前体转化为具有高反应性的NCF(3)(R)、SCF(3)和OCF(3)阴离子部分(参见图1C),这些阴离子能够作为亲核试剂参与进一步的化学反应。这一过程的亮点在于,通过连续的氯-氟交换和氟化物加成反应,将有机前体逐步转化为所需的三氟甲基亲核试剂,随后与适当的亲电试剂反应,便可形成新的C-N、C-S或C-O键。
图2. Science官网相关文章
研究者首先选取了保护的酰亚胺二氯化物(1-3)作为起始物质,并通过与氟源的反应生成了NCF(3)(PG)阴离子(参见图3),这一过程涉及三个连续的C-F键的形成,以形成亲核性中间体。值得注意的是,这些起始物质可以从经济实惠且容易获取的原料中以千克级规模制备(例如:Ts 1 30克、Cbz 2 4克、Boc 3 7克),并且可以轻松合成(15)N标记的酰亚胺二氯化物[((15)N)Ts 1 3克]。此外,试剂1为固态,而试剂2和3为液态,差示扫描量热法(DSC)和热重分析(TGA)表明试剂1具有良好的热稳定性,仅在超过180℃时才会分解。接着,研究者将Ts保护的酰亚胺二氯化物1与9当量的CsF在乙腈中混合反应2小时,通过(19)F NMR检测到了三氟甲基氨基阴离子,然后加入苄基溴并在80℃下反应2小时,以63%的产率合成了N-三氟甲基苄胺4。研究者还尝试采用流动化学方法来实现这一转化,关键在于氮原子上的电子密度,因为氮原子上电子密度较高时,三氟甲基氨基阴离子容易发生α-脱氟反应。为了减少这种分解途径并保持最佳的亲核性,研究者将18-冠醚-6与前体结合使用,通过络合铯阳离子来阻止其与氟原子的相互作用,从而稳定所需的阴离子物种。实际上,将1和18-冠醚-6(1当量)的溶液通过填充有CsF的管道,仅需7分钟即可获得NCF(3)(Ts)阴离子。研究者进一步通过评估离去基团来测试NCF(3)阴离子的反应性,发现只有与有效的离去基团反应才能成功。对于苄基底物,溴化物、碘化物、甲磺酸酯和对甲苯磺酸酯能以59-98%的产率得到产物4,而氯化物、乙酸酯、三氟乙酸酯和Katritzky盐亲电试剂则未能反应;对于正己基底物,碘化物在三氟甲烷磺酸银的作用下能以99%的产率得到三氟甲基烷基胺5,同时溴化物、甲磺酸酯和对甲苯磺酸酯也能以中等产率获得相应产物。
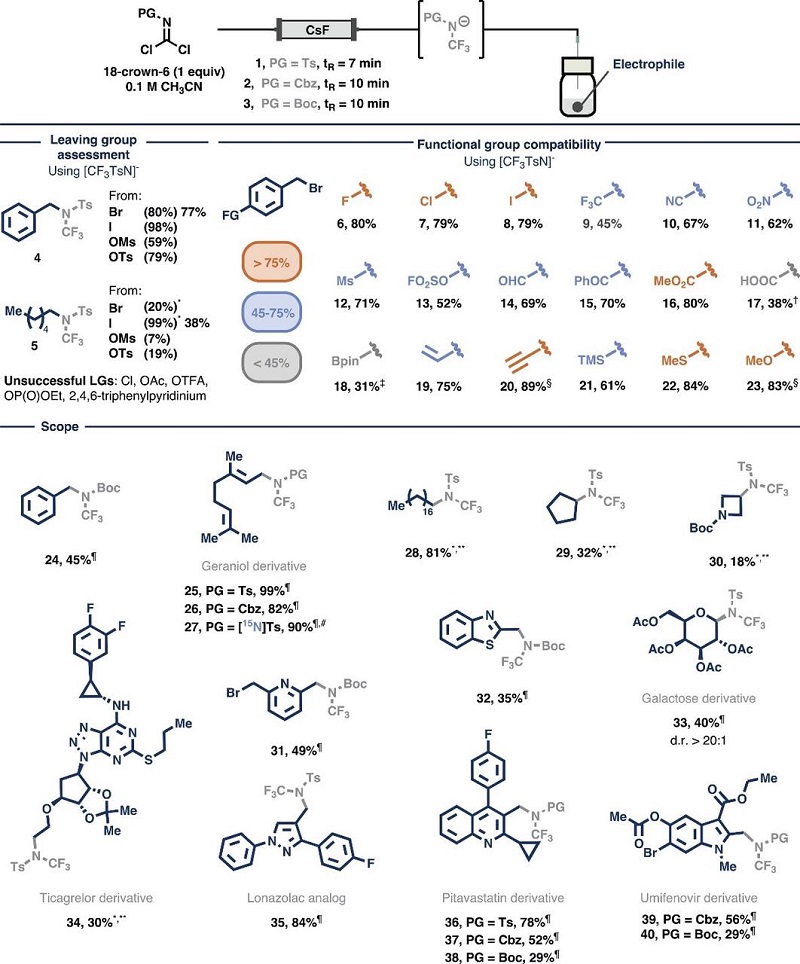
图3. NCF(3)(PG)的发展及其底物拓展。图片来源:Science
研究者进一步研究了NCF(3)(Ts)阴离子与多种官能团的相容性(参见图3),通过将由CsF填充床产生的对甲苯磺酰基保护的阴离子与多种4-取代苄基溴反应,发现该反应能够兼容带有卤素(6-8)、强吸电子基团(9-13)、羰基衍生官能团(14-16)、游离羧酸(17)、硼酸酯(18)、乙烯基(19)、乙炔基(20)和供电子基团(21-23)的苄基溴,且能以中等至良好的产率得到目标产物。此外,研究者还扩展了亲电试剂的底物范围,证实了不同保护基团的NCF(3)片段能在80℃下反应2小时,有效地与苄基和烯丙基(24-26)进行组装,特别是(15)N CF(3)(PG)也能以90%的产率合成(15)N标记的产物27。值得注意的是,伯烷基和仲烷基碘化物(28-30)、氮杂芳基溴化物(31、32)、Ac保护的半乳糖基溴化物(33)以及多种API中间体衍生物(34-40)都能成功进行这一转化,尽管某些底物(28-30)需要添加三氟甲烷磺酸银并延长反应时间以实现反应。
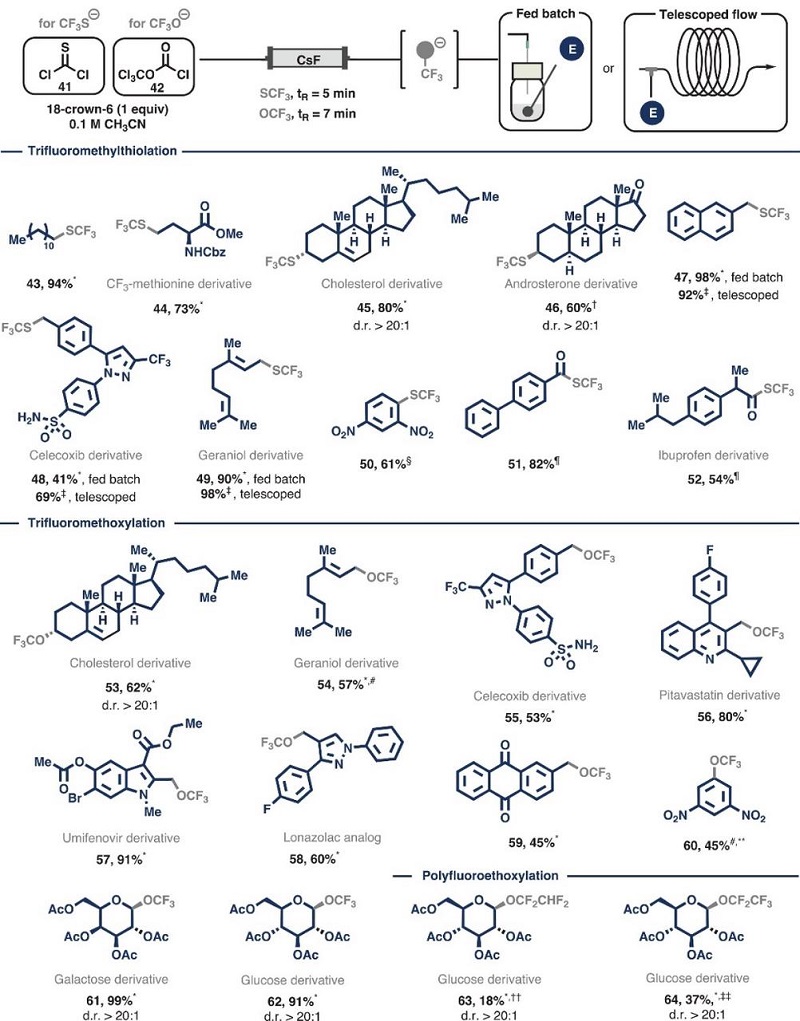
图4. SCF(3)和OCF(3)的发展及其底物拓展。图片来源:Science
研究者对引入SCF(3)和OCF(3)片段的方法进行了深入研究,选择了硫光气(41)和双光气(42)作为生成三氟甲硫基阴离子[(SCF(3))(-)]和三氟甲氧基阴离子[(OCF(3))(-)]的起始物质,并通过优化反应条件,成功制备了硫/氧属-三氟甲基亲核试剂,其中三氟甲硫基阴离子的生成时间仅需5分钟,三氟甲氧基阴离子的生成时间仅需7分钟。在最佳条件下,研究者考察了亲电试剂的底物适用性(参见图4)。对于SCF(3)片段,研究者发现伯烷基(43-44)和仲烷基(45-46)亲电试剂、苄基和烯丙基底物(包括塞来昔布衍生物,47-49)均能适应该反应,以41-98%的产率获得三氟甲硫基化产物,特别是底物47-49还能通过流动化学的方式高效合成,将反应时间从2小时缩短至5分钟,产率保持不变。此外,生成的SCF(3)阴离子还能进行芳香亲核取代反应,生成Csp(2)-SCF(3)产物(50),以及亲核酰基取代反应,生成硫酯(51-52)。对于OCF(3)片段,仲烷基溴代物(53)、具有多个官能团和杂环骨架的烯丙基和苄基底物(54-59)均能顺利完成转化,以良好至优异的产率获得目标产物。三氟甲氧基阴离子也能进行芳香亲核取代反应(60),并用于糖基底物的修饰(61和62)。值得注意的是,该反应还能扩展到更长的聚氟乙氧基链,通过使用氟烷基酸酐作为阴离子前体,这些底物在流过CsF填充床时首先形成酰氟,然后在第二次氟化物加成时形成烷氧基阴离子,从而获得了四氟乙氧基和五氟乙氧基衍生的糖基产物(63和64)。
Timothy Noël教授的研究团队采用流动化学技术,使用氟化铯作为单一氟源,成功将市面上容易获得或制备的稳定有机前体转化为高反应性的三氟甲基-杂原子阴离子,包括CF(3)-N、CF(3)-S和OCF(3)-O。这些阴离子能够与合适的亲电试剂反应,形成新的C-N、C-S或C-O键。这一策略避免了使用对环境有潜在危害的全氟烷基起始材料,为合成氟化合物提供了一种更加环保的新途径。
前衍可提供的实验用原料
 |
 |
 |
|
13400-13-0 氟化铯 |
17455-13-9 18-冠醚-6 |
2923-28-6 三氟甲烷磺酸银 |
