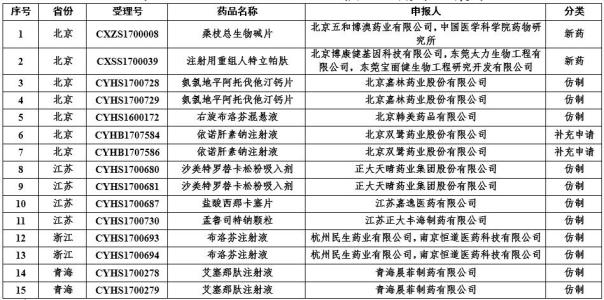
4月4日,国家药监局发布《关于药物临床试验数据自查核查注册申请情况的公告(2019年第21号)》,决定对新收到的15个已完成临床试验申报生产的药品注册申请(见附件)进行临床试验数据核查。
公告显示,在国家药品监督管理局组织核查前,药品注册申请人自查发现药物临床试验数据存在真实性问题的,应主动撤回注册申请,国家药品监督管理局公布其名单,不追究其责任。
国家药品监督管理局食品药品审核查验中心将在其网站公示现场核查计划,并通知药品注册申请人及其所在地省级药品监管部门,公示期为10个工作日,公示期结束后,该中心将通知现场核查日期,不再接受药品注册申请人的撤回申请。并对进行核查中发现的数据造假的申请人、药物临床试验责任人和管理人、合同研究组织责任人,国家药品监督管理局将依法严肃处理。
根据名单,此次核查共涉及14家单位,包括嘉林药业、双鹭药业、正大天晴、民生药业、正大丰海制药、晨菲制药、嘉逸医药等。
相关阅读:
关键词:药品,临床试验
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1