今年以来,新冠肺炎疫情席卷全球,美国在应对疫情的同时,FDA的新药审批依旧给力。4月,FDA陆续批出5款创新药,包括4款生物药和1款化学药。
图1:2000年至今FDA批准的新药数
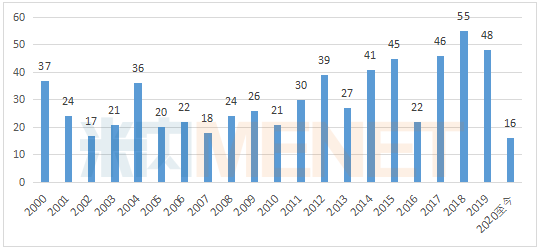
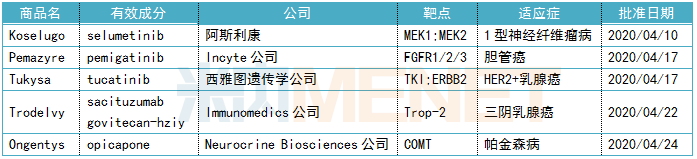
2020年4月,美国FDA批准5款创新药,其中包括治疗1型神经纤维瘤病的Koselugo、治疗胆管癌的Pemazyre、治疗HER2阳性乳腺癌的Tukysa、治疗三阴乳腺癌的Trodelvy,以及治疗帕金森病的Ongentys。获批上市的新药含金量极重,囊括多个突破性疗法、多个首款。
全球药物研发市场的趋势风口,在4月获批的新药上表现得淋漓尽致。一方面生物药是目前全球最具投资价值的医药细分领域。凭借生物药卓越的疗效,2019年全球最畅销10款药物中有7款是生物药,排在榜首的是“药王”阿达木单抗。4月批准的创新药有4款是生物药,包括3款单抗和1款ADC药物,可谓相当亮眼。另一方面肿瘤药市场火热依旧。肿瘤因为发病机制的迥异,且患者人群庞大,是各大研发企业竞相角逐的大蛋糕。4月批准的创新药中抗肿瘤药占80%,无论是罕见瘤种1型神经纤维瘤病、胆管癌,还是高发瘤种乳腺癌,让患者拥有新希望。
表1:FDA批准新药的详细信息
零的突破
Koselugo(selumetinib)
4月10日,美国FDA批准阿斯利康的激酶抑制剂Koselugo(selumetinib)上市,用于2岁及2岁以上患有1型神经纤维瘤病(NF1)的儿童治疗症状性、无法手术切除的丛状神经纤维瘤(PN)。Koselugo是1型神经纤维瘤病领域的突破,成为首款获得FDA批准用于治疗该病的药物。此前,Koselugo已获得FDA授予的孤儿药资格、罕见儿科疾病用药、突破性疗法认定和优先审评资格等资格认定。目前,该药也已向欧洲药品管理局(EMA)提交了上市申请。
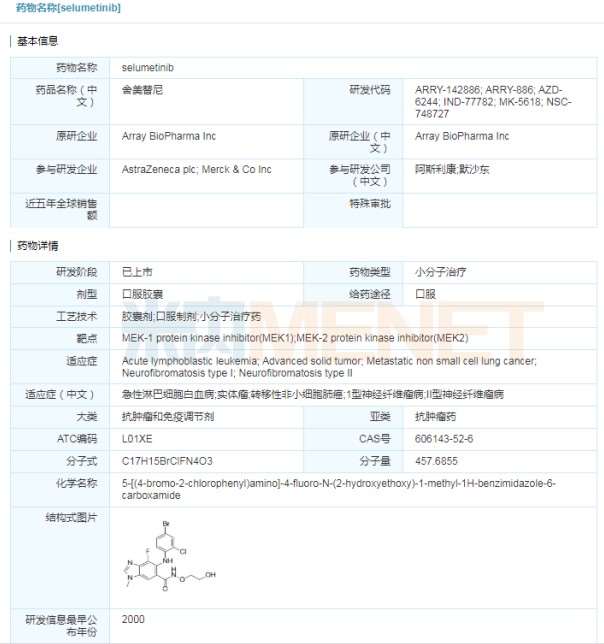
1型神经纤维瘤病是一种罕见的、令人衰弱的遗传病,大约3000~4000个新生儿就有1个患病。30%-50%左右的1型神经纤维瘤病患者神经鞘内会生长丛状神经纤维瘤。这些丛状神经纤维瘤可引起很多临床问题,如疼痛、运动障碍、气道功能障碍、肠/膀胱功能障碍和畸形。此次批准主要基于美国国家癌症研究所的一项临床试验。试验结果表明,Koselugo作为口服单药治疗的总缓解率(ORR)达66%(50例患者中有33例确诊为部分缓解),这些患者中,82%的患者缓解持续时间达到了12个月或更长。
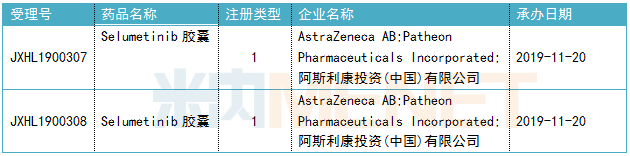
Koselugo的活性成分selumetinib是一款选择性MEK1/2激酶抑制剂,MEK是RAS/MAPK信号通路中的关键蛋白激酶,而NF1的发病正是由于NF1基因突变扰乱了RAS/MAPK信号通路所导致的肿瘤生长。目前,由阿斯利康申报的selumetinib胶囊已获得我国临床默示许可,用于3岁及3岁以上儿童和青少年患有症状性和/或进展性、无法手术的1型神经纤维瘤相关丛状神经纤维瘤治疗。
表2:selumetinib胶囊获批临床信息
信达再下一城
Pemazyre(pemigatinib)
4月20日,信达生物宣布,美国FDA加速批准其合作伙伴Incyte公司靶向抗癌药Pemazyre(pemigatinib)上市,用于治疗既往接受过治疗、采用FDA批准方法检测的具有FGFR2基因融合或其他重排且不可手术切除的局部晚期或转移性胆管癌成人患者。Pemazyre冲胆管癌传统治疗的困境,是首款获得批准用于治疗胆管癌的靶向药物。此前,Pemazyre已获得FDA授予的突破新疗法、孤儿药、优先审批等多项资格认定。
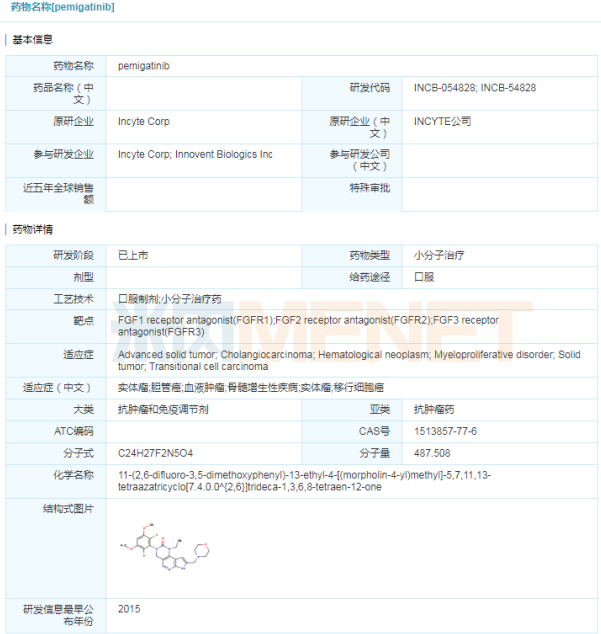
优异的临床试验数据为Pemazyre获批奠定坚实的基础。在一项名为FIGHT-202的国际多中心、开放性、单臂2期临床研究中,Pemazyre治疗存在FGFR2融合/重排患者的客观缓解率达35.5%,疾病控制率超过80%,且起效迅速、作用持久。Pemazyre为胆管癌患者带来更高质量生存的希望。
2018年末,信达生物和Incyte公司就Incyte的3个临床阶段候选药物达成了战略合作,包括pemigatinib、itacitinib和parsaclisib。信达生物拥有以上3个药物在中国(包括香港/澳门、台湾地区)的开发和商业化权利。pemigatinib国内已启动2期临床试验,信达生物在2020年3月宣布pemigatinib完成中国首例患者给药。
“女性杀手”组合药
Tukysa(tucatinib)
4月18日,西雅图遗传学公司宣布,其靶向抗癌药Tukysa(tucatinib)获得美国FDA批准,与曲妥珠单抗和卡培他滨联合使用,治疗此前已接受至少一次抗人表皮生长因子受体-2(HER2)疗法的晚期无法切除或转移性HER2阳性的乳腺癌成人患者,包括发生脑转移的患者。Tukysa是一种靶向HER2的口服小分子酪氨酸激酶抑制剂(TKI),此前已获得FDA授予的孤儿药资格、突破性药物资格和优先审查。相比FDA目标行动日期提前了4个月获批的Tukysa目前也在接受欧洲药品管理局(EMA)的审查。
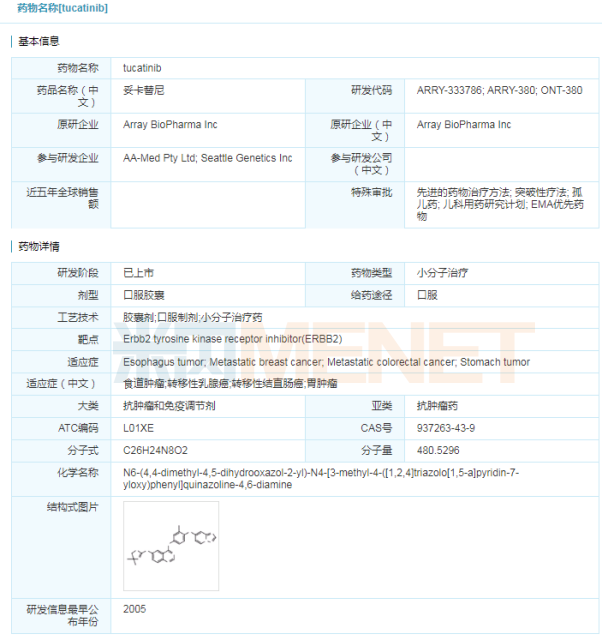
乳腺癌是著名的“女性杀手”,发病率占据女性恶性肿瘤首位。据统计,我国每年新增乳腺癌患者近30万人左右,其中HER2阳性占15%~25%。此次批准得到名为 HER2CLIMB 的临床试验数据支持。数据表明,与曲妥珠单抗+卡培他滨方案相比,Tukysa三药方案将疾病进展或死亡风险显著降低了46%,显著延长了无进展生存期、总生存期,客观缓解率提高将近一倍(40.6% vs 22.8%),对于脑转移患者中,Tukysa三药方案同样显示优秀的疗效。
Tukysa的活性药物成分tucatinib,这是一种口服生物有效的酪氨酸激酶抑制剂(TKI),对HER2具有高度选择性。HER2是治疗乳腺癌的重要靶点,虽然目前尚未有国产HER2抗体获批,但HER2市场竞争激烈,申报HER2抗体的企业已超过20家,包括复宏汉霖、信达生物、嘉和生物等,广度涉及单抗、双抗、ADC药物。
表3:国内HER2靶点药物研发情况(部分)

ADC药物持续火爆
Trodelvy(sacituzumab govitecan-hziy)
4月22日,美国FDA正式批准Immunomedics公司的抗体偶联药物(ADC)Trodelvy(sacituzumab govitecan-hziy),用于治疗至少接受过两次转移性疾病治疗的三阴性乳腺癌成人患者。Trodelvy是获得FDA批准的首款治疗三阴乳腺癌的抗体偶联药物,也是全球首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。此前,FDA授予了Trodelvy突破性药物资格、快速通道和优先审查。

三阴乳腺癌是乳腺癌的一种分型,特指雌激素受体、孕激素受体以及人表皮生长因子受体均呈阴性的乳腺癌患者,在乳腺癌学界有最难治且最“毒”分型的恶称。此次批准基于一项纳入了108例既往至少接受过2种标准化疗进展复发的晚期三阴乳癌患者的多中心、单臂的2期临床试验数据。结果表明,Trodelvy单药治疗整体缓解率为33.3%,最佳临床获益率高达45.4%,中位缓解持续时间为7.7个月,中位无进展生存期(PFS)为5.5个月。更甚,其三期ASCENT临床试验因结果数据惊艳,已在今年4月提前终止。
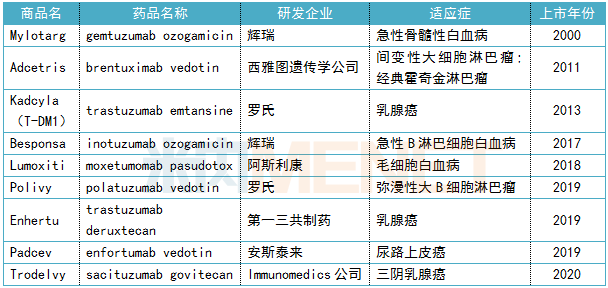
自从2019年美国FDA连续批出3款ADC药物,ADC打了场“翻身仗”,如今已成为火爆全球的研究领域。至今,包括sacituzumab govitecan在内,全球已有9款ADC药物获批上市,恩美曲妥珠单抗(trastuzumab emtansine)作为首个ADC药物今年1月在中国上市,不少国内药企也纷纷布局,其中研发进展最快的是百奥泰的BAT8001。
表4:已上市ADC药物信息
帕金森病又一新药
Ongentys(opicapone)
近日,Neurocrine Biosciences公司宣布,美国FDA批准Ongentys(opicapone)作为左旋多巴/卡比多巴辅助治疗药物,治疗经历“关闭”期的帕金森病患者。Ongentys是首款获得FDA批准的可减少“OFF”期时间且不会引起运动障碍的儿茶酚氧位甲基转移酶(COMT)抑制剂。该药最早由BIAL Pharmaceuticals公司研究开发,并于2016年6月在欧盟上市。2017年Neurocrine Biosciences公司在BIAL Pharmaceuticals公司手中获得美国和加拿大的独家开发和商业化权利;2018年,复星医药获得opicapone在中国市场的独家权利。
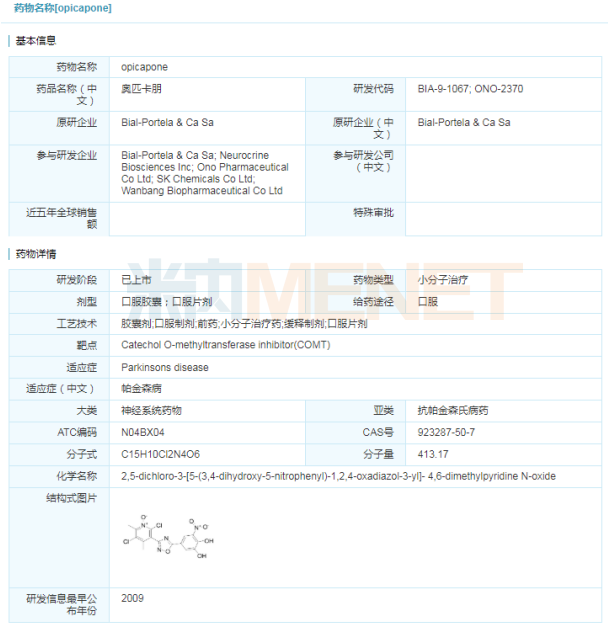
帕金森病是常见的神经系统疾病,目前尚未彻底治愈的方法。左旋多巴是治疗帕金森b病最常见有效的药物,但是,随时间推移与病情的发展,左旋多巴的最佳作用不能发挥,会导致PD症状(运动和非运动)重新出现,这些时期被称为“OFF”期。“OFF”期PD运动症状增加,如震颤、运动减慢和行走困难,会扰乱患者进行日常活动的能力,而Ongentys可以有效延缓“OFF”事件的出现。
Ongentys的有效性和安全性在大量临床试验数据中得到验证,其中BIPARK-1和BIPARK-2两项3期临床试验数据均表明,与安慰剂相比,患者接受50mg Ongentys治疗后显著减少了从基线到第14/15周的“OFF”时间。与安慰剂组相比,从基线到第14/15周,患者无运动障碍的“ON”时间也有所增加。
关键词:FDA 创新药 阿斯利康 信达
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1