类器官是一种来源于自体细胞培养的多细胞三维组织,被认为是动物模型的优质替代模型。类器官模型具有比二维细胞模型寿命更长以及完全没有与动物试验相关的伦理问题等优势。此外,类器官具有器官的鲜明特征,与实际器官具有高度的相似性,类器官的显著细胞异质性复制了真实器官的结构和复杂性。
类器官作为利用干细胞自组织形成的三维微型器官模型,近年来在基础研究和个性化医疗中展现出巨大的潜力。这些微型结构不仅能够模拟原生器官的结构和功能,还为疾病模型、药物筛选和再生医学提供了全新途径。与此同时,纳米技术的迅速发展为类器官的构建与应用注入了新的活力。
类器官与纳米材料的结合:新型工具的诞生
类器官的构建依赖于干细胞的分化和自组织能力,而纳米材料通过物理信号和化学信号的精准调控,显著提升了干细胞的分化效率。例如,金纳米颗粒(AuNPs)能够作为纳米载体,将神经营养因子递送至诱导多能干细胞(iPSCs)形成脑类器官,显著提高相关基因的表达水平。此外,磁性纳米颗粒(MNPs)通过动态磁场作用,成功实现了胚胎干细胞(ESCs)向心肌细胞的定向分化。
纳米材料还在构建3D微环境方面展现了独特优势。传统的类器官培养主要依赖二维(2D)细胞培养技术,这种技术难以完全模拟体内的三维微环境。纳米材料,如氧化锌(ZnO)纳米棒和石墨烯氧化物(GO),能够提供三维支架结构,改善细胞与细胞外基质(ECM)之间的相互作用,促进类器官的成熟和功能化。通过磁悬浮培养技术,将含有磁性纳米颗粒的细胞悬浮于液气界面,为类器官的构建提供了高效且无支架的解决方案。
纳米材料助力3D打印类器官
3D打印技术为类器官的规模化生产和精准构建提供了新工具,而纳米材料的引入进一步提升了打印效率和生物功能性。例如,甲基丙烯酸改性壳聚糖(ChMA)与纳米羟基磷灰石(nano-HAp)复合的生物墨水,不仅在打印过程中表现出良好的流变性和结构稳定性,还能显著促进骨髓间充质干细胞(BMSCs)的增殖与分化。另一项研究利用含超顺磁性氧化铁(USPIO)纳米颗粒的凝胶打印胆管类器官,不仅能够实时监测打印结构的功能状态,还可通过磁共振成像(MRI)追踪组织修复进程。
尽管如此,3D打印类器官的稳定性和可重复性仍然是制约其广泛应用的重要因素。研究者通过将金属纳米颗粒与水凝胶基质结合,改善了打印过程中材料的机械性能和生物相容性,为未来大规模类器官的定制化生产铺平了道路。
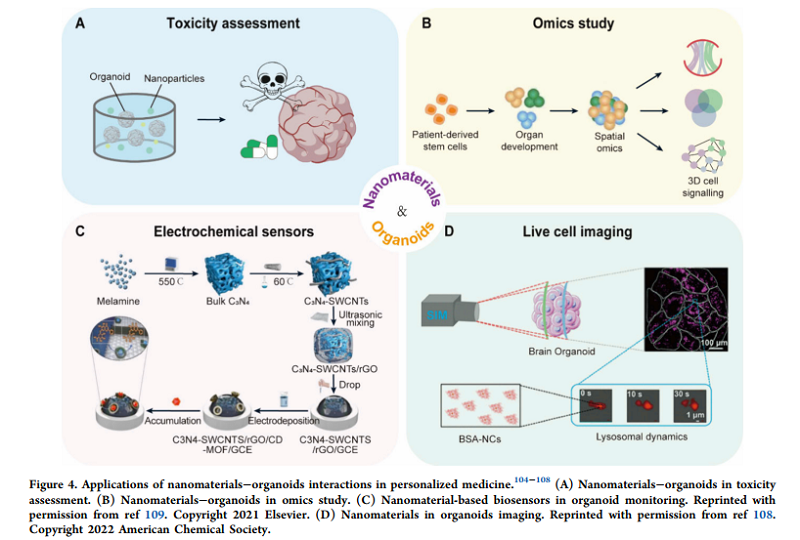
纳米材料在毒性评估中的应用
纳米材料的生物安全性是其能否广泛应用于类器官构建的重要前提。类器官由于其高度模拟体内组织环境的特性,为纳米材料的毒性评估提供了理想平台。例如,利用肾类器官评估黑磷量子点(BP-QDs)的生物安全性发现,这些纳米材料可通过非折叠蛋白反应导致肾脏损伤。此外,通过脑类器官研究发现,较高浓度的银纳米颗粒(AgNPs)会显著抑制神经突起的生长,并引发神经发育毒性。这些研究不仅揭示了纳米材料潜在的毒性机制,也为其安全性优化提供了科学依据。
纳米材料与类器官的结合为个性化医疗带来了革命性机遇。从毒性评估到疾病模型,从3D打印到功能化设计,纳米技术正在推动类器官从实验室走向临床。然而,为了实现这一愿景,研究者需进一步解决纳米材料的安全性、可重复性及其在类器官中的长期稳定性等问题。随着技术的不断进步,纳米材料与类器官的交叉研究必将在生物医学领域开辟更加广阔的天地,为患者提供更精准、更高效的个性化治疗方案。
前衍可供研究的部分纳米材料
|
中文名
|
CAS号
|
链接
|
|
纳米氧化锌
|
1314-13-2
|
订购
|
|
复壁碳纳米管
|
308068-56-6
|
订购
|
|
纳米碳酸钙
|
471-34-1
|
订购
|
|
石墨烯
|
1034343-98-0
|
订购
|
|
多壁碳纳米管
|
1333-86-4
|
订购
|
|
纳米级氧化钛
|
1317-80-2
|
订购
|
|
纳米二氧化钛
|
13463-67-7
|
订购
|
|
磷酸锆(纳米)
|
13772-29-7
|
订购
|
|
黑磷纳米片
|
7723-14-0
|
订购
|
|
碲化锡
|
12040-02-7
|
订购
|
|
纳米二氧化硅
|
60676-86-0
|
订购
|
|
亲水型纳米二氧化硅
|
7631-86-9
|
订购
|
|
疏水型纳米二氧化硅
|
68611-44-9
|
订购
|
|
纳米碳化硅
|
409-21-2
|
订购
|
|
巴克明斯特富勒烯
|
99685-96-8
|
订购
|
|
纳米金刚石
|
7782-40-3
|
订购
|
|
富勒烯
|
131159-39-2
|
订购
|
|
纳米四氧化三铁
|
1317-61-9
|
订购
|
|
纳米氧化钙
|
1305-78-8
|
订购
|
|
纳米氧化钴
|
1308-06-1
|
订购
|


![]()
![]()



