2018年,医药外企在华共上市了44个新药,占全部获批新药的77%。在这其中,吉利德上市新药势头最猛,BI上市数量最多,赛诺菲对罕见病药情有独钟,而“全球大药厂”辉瑞最失意,近两年仅在华上市两款新药。
近日,IDEA制药发布了第9次制药企业年度创新指数(PII),其中吉利德首次登上行业创新的榜首,其次是艾伯维、礼来、辉瑞、默沙东、赛诺菲、诺和诺德、罗氏、诺华和葛兰素史克。该排名反映了药企将产品从临床1期、2期试验阶段推向市场并成功实现商业化的能力。
而在中国,随着中国新药审评审批不断改革以及临床试验改革,医药外企创新药在中国的研究、准入和商业化能力也越来越成为在华重要的竞争因素。尤其是“4+7带量采购”之后,医药外企的专利过期原研药高增长模式将不复存在,更加印证了这一策略。未来,医药外企在中国比拼的也是创新药!
2018年,中国市场共获批上市了57个新药,在数量上逼近了美国FDA破纪录的59个新药,反映了NMPA的审评审批效率与其不相上下。其中进口化学药33种,进口生物药11种,医药外企在华共上市了44个新药,占全部获批新药的77%。获批数量的持续增加,也从侧面反映了跨国公司为了扩大各自的产品线而做出了不少努力。
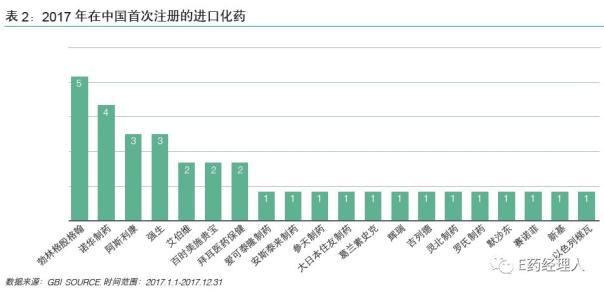
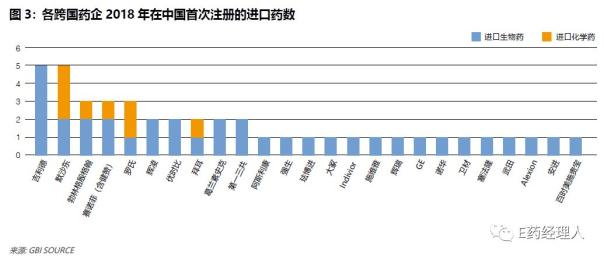
其中,2018年在华上市新药最多的前5家药企分别是吉利德、默沙东、勃林格殷格翰、赛诺菲、罗氏。这与2017年的排名略有不同:2017年,在华上市新药最多的前5家药企分别是勃林格殷格翰、诺华、阿斯利康、强生、艾伯维/百时美施贵宝/拜耳。
这些医药外企巨头在华的创新药家底如何?谁家上市最多?谁家放量最快?谁家在招数上出其不意?
01、吉利德:迅猛扩张肝炎市场
2018年,吉利德在中国市场上市了5款新药,加上2017年的一款,15个月内6款创新药获批上市,使其成为2018年医药外企在华获批新药的最大赢家。
这家2016年才完全进入中国市场的美国公司,显然在中国市场将新药当成发力重点。2018年获批的五款创新药均扎根于肝炎和HIV/艾滋病市场,并在中国创造了多个“第一”。
2018年5月,继重磅丙肝药索华迪在华上市后,吉利德又一重磅新药丙通沙(索磷布韦/维帕他韦)在华获批用于治疗基因1-6型慢性丙型肝炎病毒(HCV)的成人感染患者,也自此成为中国首个通过审批的泛基因型HCV单一片剂方案(STR)。
获批5个月后,丙通沙于当年10月入选《国家基本药物目录(2018年版)》,并很有可能在新一轮医保目录调整中纳入医保。
2018年8月,捷扶康(艾考恩丙替片)在华获批用于治疗HIV-1感染,成为我国首个获批的含有TAF/FTC、用于治疗成年和青少年HIV感染的单一片剂方案。相比多片剂方案,“多合一”,“一天一片”能更好提高患者用药依从性。在全球,捷扶康2017年为吉利德带来超过36亿美元的销售额,比2016年14.84亿美元相比增长了148%。
2018年11月,吉利德连续三款新药在华获批,分别为治疗慢性乙肝的韦立得、治疗HIV-1感染的达可挥、治疗1-6型慢性丙肝的夏帆宁。
韦立得是10年来中国市场批准治疗乙肝的首个新口服药物,获批后被誉为“史上最强” 乙肝新药。韦立得具有类似于吉利德的富马酸替诺福韦二吡呋酯(TDF)的抗病毒功效,但剂量仅为后者的十分之一。
02、BI:在华2年上市8款新药
勃林格殷格翰(BI)近两年在华上市创新药数量居跨国企之最,收获颇丰。其中,2017年上市了5款创新化药,2018年也斩获了1款创新小分子化药和2款生物创新药。
其中用于治疗奥达特罗气雾剂和噻托溴铵/奥达特罗吸入喷雾剂为最新一代疗法,在国外上市超过3年,临床证据充分。两款新药的上市大幅增加了COPD的临床治疗选择,同时也有望改变哮喘和COPD治疗市场目前“一家独大”的现状。
2017年,BI用于治疗高血压的替米沙坦·氨氯地平(双加)、治疗2型糖尿病的恩格列净(欧唐静)和利格列汀·二甲双胍(欧双宁)、治疗特发性肺纤维化的尼达尼布(维加特)、治疗非小细胞肺癌的阿法替尼(吉泰瑞)接连获批上市,不仅大大丰富了创新药管线,也使勃林格殷格翰在中国拓展到心血管、代谢、肿瘤、呼吸系统、中枢神经系统、免疫学等更多的疾病治疗领域。
03、辉瑞:“全球大药厂”的失意
与其他医药外企相比,“全球大药厂”辉瑞这两年在华上市创新药方面却略显失意。近日,在上海召开的第四届中华医学事务年会(CMAC)上,辉瑞中国首席医学官谷成明就公开调侃:“我们近两年没有太大压力,因为我们在华没有新药上市。”
虽然数量较少,实际上辉瑞在华近两年也各自获批了一款新药。2017年用于治疗类风湿关节炎的口服JAK抑制剂托法替布在华上市申请,2018年用于治疗乳腺癌的哌柏西利胶囊(爱博新)获批。
值得一提的是,2017年获批的托法替布是第一个被批准治疗类风湿关节炎患者的JAK 抑制剂,已经在全球在全球50多个国家获批。2018年7月在华获批的哌柏西利是全球第一个周期蛋白依赖性激酶(CDK)4/6的选择性抑制剂。2013 年美国食品与药品管理局(FDA)核准爱博新为治疗晚期乳腺癌的突破性新药,2015 年FDA 以快速审批程序批准爱博新上市,用于治疗晚期乳腺癌。基于此,美国国立综合癌症网络(NCCN)指南推荐爱博新联合芳香化酶抑制剂作为HR+/ HER2-晚期或转移性乳腺癌的一线治疗方案。
在全球市场,爱博新上市第二年销售额就突破了20亿美元,2017年更是达到了35亿美元,增长率超过117%。但目前其在中国定价较高,每盒价格为2.98万元,半年需要7盒,即20.86万元。
但这款重磅新药在中国的好日子并不长。2018年11月,CPM数据显示齐鲁制药递交的哌柏西利胶囊仿制药申请变更为受理状态,此外,豪森、恒瑞、海正、正大天晴等13家企业都在进行哌柏西利胶囊的临床试验。虽然目前爱博新还处于专利期,但可以预见不久之后,这款产品将进入激烈的竞争状态。辉瑞也将承受较大压力。
2018年11月21日,辉瑞的哌柏西利胶囊出现在深圳市重特大疾病补充医疗保险药品目录中。迫于仿制药压力,辉瑞也许会寻求降价或进医保途径提前抢占市场。
04、赛诺菲:钟情罕见病药
赛诺菲2018年在华上市3款新药,相比于2017年的1款新药略有增加。而这3款新药中有两款都是罕见病药。
中国正逐渐提高对罕见病治疗领域的关注,2018年5月,五部委联合公布《第一批罕见病目录》,为罕见病的诊治提供强大的政策支持。2019年3月28日,CDE公布第二批临床亟需境外新药名单,其中包括了14个罕见病药。
2018年7月,赛诺菲的特立氟胺片奥巴捷在华获批用于用于治疗复发型多发性硬化症(MS),这也是目前在国内获批的治疗多发性硬化的首款口服型疾病修正治疗药物。多发性硬化已经被纳入中国《第一批罕见病目录》。从获批到供药, 奥巴捷仅仅用了58天,创下了近期国内罕见病创新药物从获批到上市的“最快速度”。
2018年12月,赛诺菲旗下健赞的罕见病治疗药释倍灵(普乐沙福注射液)在华获批。作为新一代的造血干细胞移植动员剂,释倍灵可显著提高造血干细胞采集成功率,使患者通过移植获得更多的治愈机会。
自从收购了美国罕见病巨头健赞之后,赛诺菲就对罕见病情有独钟,在血友病和罕见病领域布局深耕。在全球,赛诺菲在2018年收购了比利时药企Ablynx,后者主打新药是治疗罕见血液凝血障碍的新药。2018年初,赛诺菲以116亿美元收购了Bioverativ。这个药企专攻血友病。这两次收购花了赛诺菲164亿美元。
近期,山西省还确定将赛诺菲旗下两款罕见病药物——治疗戈谢病的特效药思而赞与治疗庞贝氏病的特效药美而赞纳入大病保险用药范围,并确定了医保支付标准。接下来,政策会在审评、准入、医保、定价等各方面给予罕见病药物相应的支持,罕见病在中国或许也将成为孕育“重磅炸弹”的摇篮。
近期,赛诺菲执行副总裁、普药与新兴市场全球负责人夏立维还在接受采访时透露,罕见病将成为赛诺菲中国战略的重要组成部分,为此,赛诺菲还将在中国和新兴市场组建一个新的业务部门。
相关阅读
4、绿叶制药Rykindo有望成为我国首个在美获批上市的创新药
关键词:医药外企,吉利德公司
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1