4月15日,ClinicalTrials.gov更新显示,吉利德在中国进行的瑞德西韦(remdesivir)用于治疗轻度至中度COVID-19成人患者的试验的注册状态显示为“已暂停”,原因是目前中国COVID-19流行已得到很好地控制,无法招募合格入组的患者。
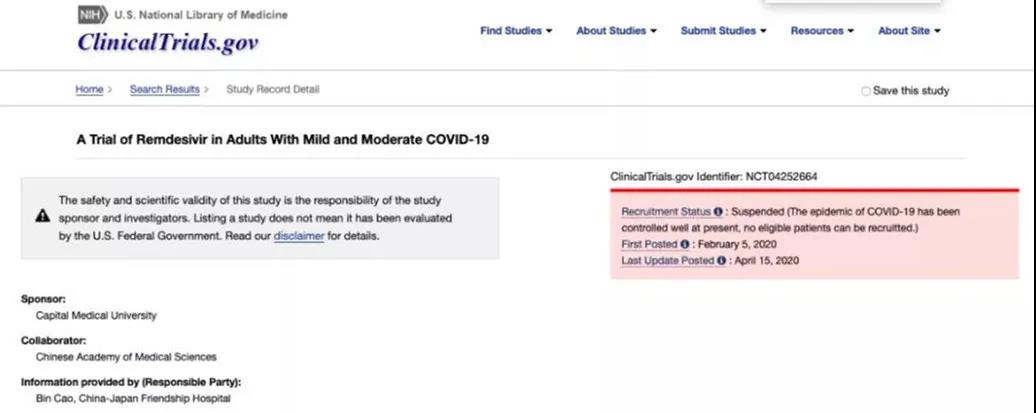
据悉,这项随机、双盲、安慰剂对照、多中心3期临床研究(NCT04252664)始于今年2月初,计划入组308例轻中度患者,随机分配到瑞德西韦治疗组或安慰剂组。治疗组患者在第1天给予瑞德西韦200mg负荷剂量,随后每天一次100mg静脉内维持剂量,持续9天。对照组患者则给予同样方案的安慰剂。主要终点是在最长28天内患者的临床恢复时间,定义为研究治疗开始到患者发热(<37度)、呼吸频率(≤24次/分钟)、血氧饱和度(>94%)、72小时咳嗽症状(轻度或无咳)等指标缓解。次要终点为全因病死率、呼吸症状的进展、退烧时间、呼吸困难减轻的时间、上呼吸道样本中2019-nCoV RT-PCR转阴性的时间、上呼吸道样本中2019-nCoV病毒载量减少的变化、机械通风需求的频率以及严重不良事件的发生频率。
此前研究人员认为,在发展为重症之前接受瑞德西韦治疗,患者更有可能从该药物受益。但由于缺乏入组患者,这已经是吉利德一周内在中国停止的第二项瑞德西韦研究。上周末,吉利德宣布暂停该药在重症患者中的3期临床。许多投资者对该消息表示震惊,因为这两项试验是目前瑞德西韦用于COVID-19唯一的随机研究。
几天前,吉利德在《新英格兰医学》杂志上发表的一篇针对接受瑞德西韦同情用药治疗效果的论文,在最终53例患者的可分析队列中,有超过一半需要机械通气的患者已拔管,几乎一半的患者出院。结果显示出,该药疗效“50/50”,即对半数患者有效。但该研究分析存在一个很大的缺陷,就是缺少控制对照组,因此很难从数据中得出确切、严谨的结论。但一个明显的积极现象是,该药物缺乏安全危险信号,这一点从瑞德西韦在更大规模的埃博拉感染患者研究中的表现就可以看到。
但研究人员怀疑,最新的研究数据是否具有某种暗示意义。英国伦敦卫生与热带医学学院药物流行病学教授Stephen Evans对彭博社表示:“有一些证据表明瑞德西韦有疗效,但是我们不知道如果不给患者药物,他们会发生什么。”加拿大皇家银行的分析师Brian Abrahams也表示:“所有的研究结果均暗示出该药的疗效有限。”吉利德也承认现有研究存在局限性。
吉利德针对瑞德西韦治疗COVID-19已进行了至少五项临床试验,目前其在欧洲和美国的其他试验仍在进行中,并且对暂停的研究也会分析、提取数据结果。本月将至少有一至两项研究计划发布结果。
Abrahams指出:“4月下旬吉利德将公布一项瑞德西韦用于重症COVID-19患者的3期临床试验SIMPLE关键分析结果,但由于缺乏控制组,对结果的解释可能有限。5月份还将公布该试验针对中度患者的研究数据。美国国家过敏和传染病研究所(NIAID)领导的瑞德西韦研究数据最快也可能在5月发布。”
即使吉利德曾一再声明瑞德西韦不会成为其未来产品线中重要的基石,但许多人押注,即使不能成为吉利德的利润中心,但瑞德西韦也将是一款重要产品,尤其是考虑到需求的广泛和迫切性。Needham分析师Alan Carr表示:“相信在确定该瑞德西韦能上市用于COVID-19治疗后,吉利德就会评估后续批次的定价策略选择。”据知情人透露,吉利德已经生产了150万瓶瑞德西韦,将用于患者治疗。
参考来源:
1、Gilead Suspends a Remdesivir COVID-19 Trial in China
2、UPDATED: Gilead takes a hit after a closely-watched Covid-19 trial of remdesivir is quietly terminated, raising fresh doubts
关键词:瑞德西韦 临床试验
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1